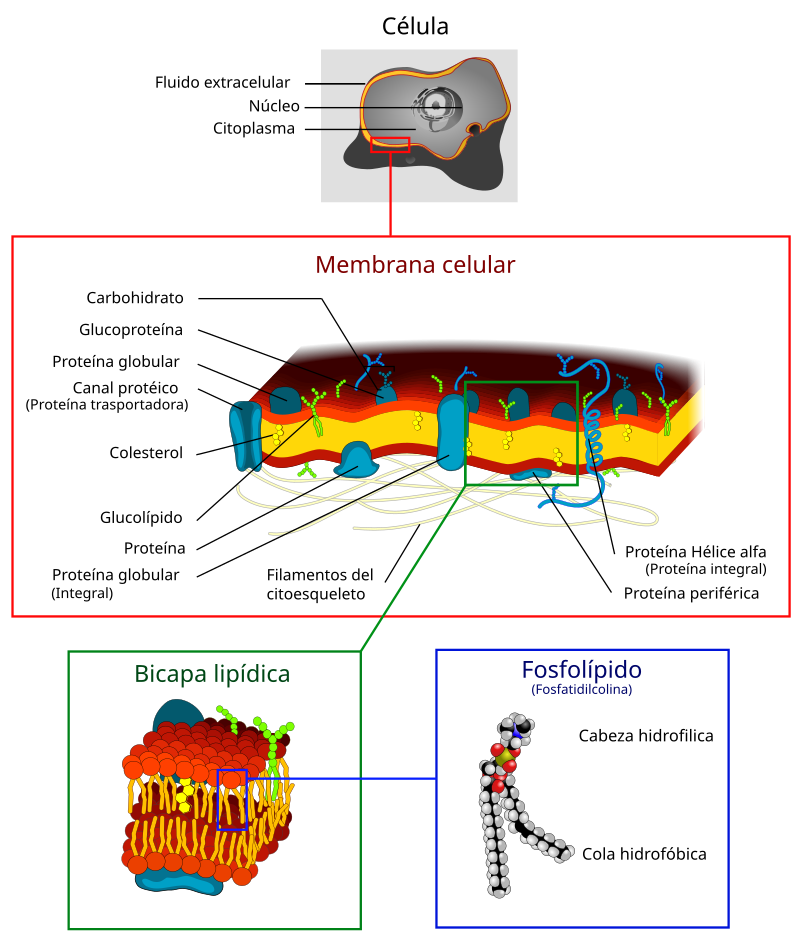
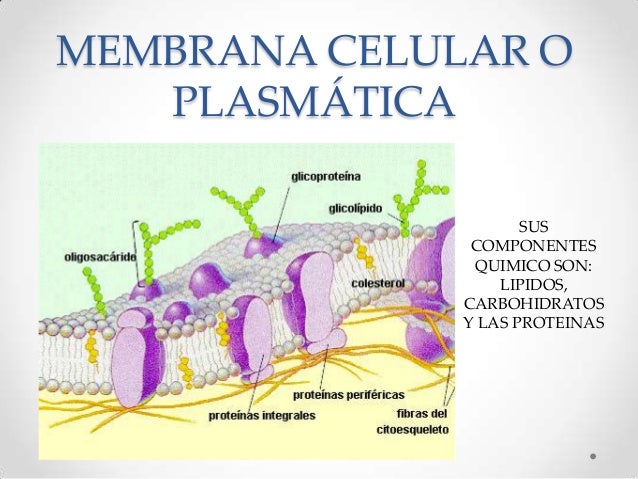
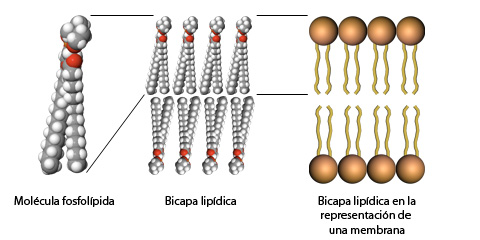
ENZIMAS
PROPIEDADES GENERALES
Una enzima
es una proteína que actúa como catalizador biológico, llevando a cabo
reacciones bioquímicas a muy altas velocidades, no se consume durante la
reacción y en general presenta un elevado grado de especificidad. Las enzimas
así como cualquier otra estructura presentan propiedades generales que las
logran caracterizar en su totalidad.
1) Son los catalizadores de las reacciones químicas de los
sistemas biológicos.
Los
catalizadores son sustancias que modulan o influyen en la velocidad de las
reacciones sin alterar su punto de equilibrio. Los únicos catalizadores del
mundo son las enzimas, estas aceleran las reacciones químicas de los sistemas
biológicos, participan en una reacción y experimentan cambios físicos durante
ella, pero regresan a su estado original cuando la reacción termina. Las
enzimas hacen posible la vida en la tierra; en ausencia de estas, la mayoría de
las transformaciones químicas requeridas para mantener activas las células
tardarían mucho tiempo en efectuarse o simplemente no procederían.
2) Las enzimas aceleran las reacciones químicas de los
sistemas biológicos.
Las
moléculas en enzimas son catalizadores extraordinarios, muy eficientes para
acelerar la transformación de sustratos en productos finales. Una sola molécula
de enzima puede efectuar el cambio de 10 000 a 1 millón de moléculas de
sustrato por minuto.
3) No cambian la constante de equilibrio de las reacciones
que catalizan.
La
concentración de la enzima no tiene efecto sobre la constante de equilibrio.
Dicho de otra manera, puesto que las enzimas afectan a las velocidades y no a
las constantes de velocidad, ellas no pueden afectar a Keq (constante de
equilibrio), que es una relación de constantes de velocidad. De aquí que la Keq
de una reacción sea la misma independientemente de que se alcance el equilibrio
con catálisis enzimática o sin ella.
4) Poseen un elevado grado de especificidad de sustrato
La gran
mayoría de las enzimas tiene la capacidad de catalizar reacciones más o menos
específicas; es decir, su intervalo de acción se limita a un determinado tipo
de compuesto que debe reunir ciertas características para que pueda ser
utilizado como sustrato. En concreto esto significa que las células
generalmente producen diferentes enzimas para cada compuesto que metabolizan.
Además, cada enzima interviene en un solo paso o cambio del sustrato.
5) La mayoría de las enzimas son proteínas.
Todas las
enzimas se presentan como proteínas, tienen una estructura tridimensional
globular, están formadas generalmente por una sola cadena
polipeptídica,
y sólo logran ser activas cuando los polímeros desarrollan una conformación que
permite establecer su centro activo. La mayoría de las enzimas están
constituidas por más de 100 aminoácidos, los cuales confieren a la molécula una
masa mayor de 10kDa y un diámetro de 25Å.
6) No se
consumen ni se alteran durante el proceso químico que están catalizando,
pudiendo actuar una y otra vez.
Las enzimas
no se consumen ni se alteran durante la reacción, por lo que pueden actuar en
pequeñas cantidades ya que una misma enzima puede catalizar varias reacciones.
7) Aceleran
la velocidad de la reacción al disminuir la energía de activación.
Las enzimas
son moléculas que están para disminuir la energía de activación solo de las
reacciones necesarias para la supervivencia celular.
FACTORES
QUE INFLUYEN EN EL TRABAJO ENZIMÁTICO
Debido
a su naturaleza química, a las enzimas les afectan los mismos factores que
alteran a las proteínas; por esta razón, cada una de ellas requiere de ciertas
condiciones para trabajar óptimamente como la temperatura, el pH, la fuerza
iónica, etcétera. Otros factores que influyen en el trabajo enzimático son:
concentración de la enzima y concentración del sustrato.
1.
Efecto de la temperatura.
Como
sucede en la mayoría de las reacciones químicas, la velocidad de las enzimas
aumenta con la temperatura, debido al incremento en la energía cinética de las
moléculas reactantes (en general, por cada 10ºC de incremento, duplica e
incluso triplica la velocidad de reacción), pero esto ocurre sólo en el
intervalo de temperatura en el que la enzima es estable y retiene su capacidad
catalítica; en casos extremos, cuando se incremente mucho la temperatura, se
favorece la desnaturalización y consecuentemente esta proteína pierde su
capacidad catalizadora. Por esta razón, cada enzima tiene un intervalo óptimo
de temperatura en el cual se logra la mayor actividad; la mayoría tiene su
temperatura óptima entre 30oC y 40oC, y se inactiva a más de 55oC. La desnaturalización
puede ser reversible o irreversible, por lo que la enzima en ciertas
condiciones, llega a recuperar su función después de un tratamiento térmico.
Habitualmente
cuando el efecto de la temperatura no es muy intenso, se puede regenerar
nuevamente su actividad al adquirir otra vez su estructura tridimensional de
origen. Pero, a medida que esta es mayor, se favorece la inactivación
irreversible y el sitio activo se pierde sin tener la oportunidad de
regenerarse al enfriarse el sistema.
Habitualmente
la desnaturalización a alta temperatura es irreversible, debido a que se rompen
las fuerzas débiles de enlace al aumentar la vibración térmica de los átomos
componentes, fenómeno que daña la estructura tridimensional.
Temperaturas
extremadamente bajas, detienen la actividad enzimática pero no las destruyen.
Muchas enzimas se pueden conservar metiéndolas a 0ºC o temperaturas más bajas,
logrando recuperar su actividad después de descongelarse, según la intensidad y
la forma en la que se efectuó el congelamiento.
2. Efecto
del pH.
La
actividad de las enzimas depende mucho de la concentración de iones de
hidrógeno del medio, ya que esto afecta el grado de ionización de los
aminoácidos del sitio activo, del sustrato, o del complejo enzima-sustrato;
todo eso llega a influir en la afinidad que tenga la enzima por el sustrato.
Las
enzimas poseen grupos químicos ionizables (carboxilos -COOH; amino -NH2; tiol
-SH; imidazol, etc.) en las cadenas laterales de sus aminoácidos. Según el pH
del medio, estos grupos pueden tener carga eléctrica positiva, negativa o
neutra. Como la conformación de las proteínas depende, en parte, de sus cargas
eléctricas, habrá un pH en el cual la conformación será las más adecuada para
la actividad catalítica.
En los
casos en el que los sustratos son no ionizables (la mayoría de los hidratos de
carbono y lípidos), los grupos iónicos de las enzimas son los únicos afectados
por el pH.
Por esta
razón, todas las enzimas presentan una máxima actividad catalítica a un cierto
valor óptimo de pH, en un intervalo de 5 a 8 (El pH óptimo de la mayoría de los
enzimas es próximo a 7), aun cuando existen excepciones muy importantes, como
enel caso de la pepsina del estómago, que tiene un pH óptimo de 1.8, u otros
como la tripsina tienen un pH óptimo algo alcalino (pH óptimo = 7,8).
La
mayoría de los enzimas son muy sensibles a los cambios de pH. Desviaciones de
pocas décimas por encima o por debajo del pH óptimo pueden afectar
drásticamente su actividad. Así, la pepsina gástrica tiene un pH óptimo de 2,
la ureasa lo tiene a pH 7 y la arginasa lo tiene a pH 10 (Figura de la
izquierda). Como ligeros cambios del pH pueden provocar la desnaturalización de
la proteína, los seres vivos han desarrollado sistemas más o menos complejos
para mantener estable el pH intracelular: Los amortiguadores fisiológicos
Las enzimas además pueden
experimentar cambios de conformación con las variaciones del pH. Podría ser
necesario un grupo cargado distal a la región del sustrato donde se ha fijado,
para conservar una estructura activa terciaria o cuaternaria. Conforme cambia
la carga en este grupo, la proteína puede desenrollarse, volverse más compacta
o disociarse en protómeros, todo lo cual conduce a la perdida de la actividad.
Dependiendo de la gravedad de estos cambios, la actividad puede ser
restablecida o no cuando la enzima regresa a su pH óptimo.
3.
Concentración del sustrato
A mayor
concentración del sustrato, a una concentración fija de la enzima se obtiene la
velocidad máxima. Después de que se alcanza esta velocidad, un aumento en la
concentración del sustrato no tiene efecto en la velocidad de la reacción.
Algunas enzimas permanecen libres en concentraciones bajas de sustrato y no se
alcanza la máxima velocidad. Cuando el sustrato se encuentra en exceso, toda la
enzima se transforma en ES y la reacción se realiza a su máxima velocidad.
4.
Concentración de la enzima
Siempre y cuando haya
sustrato disponible, un aumento en la concentración de la enzima aumenta la
velocidad enzimática hacia cierto límite.
5.
Efectos de otros agentes
Las enzimas se ven
afectadas también por otros factores como son la actividad de agua, pues la
mayoría de los biopolímeros requieren de agua para desarrollar su conformación
estable con características de agentes biológicamente activo; sin embargo,
algunas enzimas llegan a actuar con un mínimo de agua, como ocurre con las
lipasas que contienen los aceites puros. En este caso la amplia disponibilidad
del sustrato hace que las reacciones se logren aun en condiciones de sequedad.
Por otra parte,
los metales pesados, como mercurio, plata y plomo, inhiben la acción
enzimática, mientras que el calcio, el magnesio, el sodio, el potasio, el
manganeso, el hierro y el zinc, actúan como agentes activadores de muchas
otras. Estos activadores se denominan Cofactores. Este efecto activador se debe
probablemente a que forman parte del sitio activo, que se requieren para la
creación del complejo enzima-sustrato, o que ayudan a mantener la conformación
tridimensional. Casi un tercio de los enzimas conocidos requieren cofactores.
Cuando el cofactor es una molécula orgánica se llama coenzima.
COFACTORES
ENZIMÁTICOS
Existen enzimas
que son proteínas simples y otras que requieren para su función la presencia de
sustancias no proteicas que colaboran en la catálisis: los cofactores. Los
Cofactores son sustancias que se combinan con el enzima potenciando su acción
catalítica.
Minerales y
su función como cofactores
Estos cofactores
suelen ser iones metálicos como hierro (Fe++), cobre (Cu++),magnesio (Mg++),
manganeso (Mn++) y zinc (Zn++), a estos cofactores se los conoce como coenzimas
inorgánicas
a.
Magnesio
·
Cofactor
de enzimas que transfieren grupos fosfatos desde el ATP.
·
Cofactor
de la enzima acetilcolinesterasa.
b.
Cobre
·
Cofactor
de enzimas Cu-dependientes que intervienen en la formación de: hemoglobina,
colágeno, lecitina, mielina.
c.
Zinc
·
Cofactor
de metalo-enzimas (anhidrasa carbónica, fosfatasa alcalina, carboxipeptidasa,
ARN polimerasa, ADN polimerasa, etc.).
d.
Hierro
·
Constitución
como cofactor de enzimas oxidasas (peroxidasa, catalasas, citocromo C, etc.)
e.
Manganeso
·
Cofactor
de enzimas como la arginasa y la ribonucleotidoreductasa
Cuando el cofactor es una
molécula de naturaleza orgánica se le llama coenzima.
NOMENCLATURA
Y CLASIFICACIÓN
Desde
sus inicios la nomenclatura enzimática ha sido poco sistemática, y carece de
los lineamientos necesarios para darles nombres adecuados. Existen muchas
enzimas cuyos nombres no ofrecen ninguna información sobre su actividad o sus
propiedades, como es el caso de la tripsina, la quimotripsina, la pepsina y
algunas otras. Unas se han designado con el nombre del descubridor, otras, como
la papaína, de acuerdo con su procedencia (papaya), y en otros casos, como la
lactasa, según el sustrato que utilizan, que en este caso es la lactosa.
Debido
a esta falta de homogeneidad en la nomenclatura, se integró la Comisión de
enzimas de la Unión Internacional de Bioquímica (UIB), que desarrolló un método
que identifica cada una con cuatro dígitos separados por puntos encabezado por
las letras EC (enzyme commission), que caracteriza al tipo de reacción según la
clase (primer dígito), subclase (segundo dígito), sub-subclase (tercer dígito),
y un cuarto dígito que es para la enzima específica.
El
primer dígito de la nomenclatura, representa el grupo al que pertenecen:
1)
Oxido-reductasas
Catalizan reacciones de
oxido-reducción, es decir, transferencia de hidrógeno (H) o electrones (e-) de
un sustrato a otro. Entre estos tenemos la succinato deshidrogenasa o la citocromo
c oxidasa
2)
Transferasas:
Catalizan la
transferencia de un grupo químico (distinto del hidrógeno) de un sustrato a
otro. Por ejemplo la glucoquinasa, que cataliza la reacción de transferencia de
un grupo fosfórico del ATP al carbono 6 de la glucosa para formar
glucosa-6-fosfato y ADP.
3)
Hidrolasas:
Llevan a cabo la
ruptura de enlaces químicos con la introducción de una molécula de agua. Un
ejemplo es la lactasa, que cataliza la reacción de rompimiento de la molécula
de lactosa mediante la adición de una molécula de agua, para formar glucosa y
galactosa.
4)
Liasas:
Catalizan
reacciones de ruptura o soldadura de sustratos sin la participación del agua.
Un ejemplo es la acetacetato descarboxilasa, que cataliza la reacción:
5) Isomerasas:
Catalizan las isomerizaciones de distintos compuestos. Entre ellas tenemos la fosfotriosaisomerasa y la fosfoglucosaisomerasa, que catalizan las reacciones representadas en la tabla inferior:
MECANISMOS
DE REACCIÓN
Por
las notables propiedades catalíticas de las enzimas y el papel que juegan en el
proceso de la vida, muchos investigadores han dado preferencia a investigar sus
mecanismos de reacción.
La
activación de la molécula de sustrato se produce debido a la gran afinidad
química (electrónica) del sustrato por ciertas áreas de la superficie de la
enzima, sitios activos. Este sitio activo corresponde a una depresión o
hendidura relativamente pequeña que posee la geometría y distribución de cargas
(positivas y negativas) para unirse específicamente y en forma complementaria a
un determinado sustrato.
El sustrato se une al sitio activo de la
enzima por medio interacciones hidrofóbicas y electrostáticas, puentes de
hidrógeno y fuerzas de van der Waals. Los residuos de aminoácidos de la enzima
que participan en la interacción con el sustrato, se encuentran alejados unos
de otros en la secuencia lineal de aminoácidos de la proteína: pero como
resultado del plegamiento de ésta, se agrupan para formar el sitio activo de la
enzima. Algunos de estos residuos participan solamente en la unión de sustrato
y definen una región del sitio activo que se llama sitio de fijación o de unión
del sustrato. Otros residuos del sitio activo, los catalíticos, se encargan
directamente de la transformación del sustrato en producto y forman el sitio
catalítico. Normalmente el número de residuos que intervienen en la unión del
sustrato es mayor que el de los residuos catalíticos. Este sitio activo es el
lugar donde a través del reconocimiento molecular ocurren reacciones de ruptura
y formación de enlaces, formándose así un complejo enzima-sustrato en el que
las moléculas de las sustancias reactantes (sustratos) quedan muy próximas
entre si, condición indispensable para que se lleve a cabo la reacción química
de ellas. Se produce una deformación o distorsión en alguna unión de la
molécula de sustrato, se hace lábil y sufre un cambio por la enzima en
particular. Las moléculas alteradas pierden su afinidad por los sitios activos
y por ello son puestas en libertad. Entonces las enzimas quedan libres e
intactas para combinarse con más sustrato y la biosíntesis de nuevos productos
iguales a los anteriores.
Se debe agregar que la
activación hace que caiga o disminuya la barrera energética que el sustrato
debe vencer antes de que se transforme en producto. Así, una reacción
catalizada por enzimas necesita baja energía de activación para que pueda
efectuarse.
Este análisis se aplica a
los sustratos que han sido degradados o también se han utilizado en la
biosíntesis. Aunque se puede aplicar el mismo tipo de explicación para
describir la síntesis, o la construcción de compuestos complejos, a partir de
otros simples. En esta forma, dos moléculas diferentes de sustrato se pueden
pegar a los sitios adyacentes en la superficie de la enzima. Una sola
activación del sustrato por la enzima permite el establecimiento de una unión
entre las dos moléculas, de tal modo que se crea un compuesto nuevo a partir de
los dos sustratos originales. Este producto tiene poca afinidad por el sitio
activo y se desprende. En realidad el sitio activo y se desprende.
En realidad, el sitio activo
de la superficie de una enzima es un área muy pequeña, lo que significa que las
grandes porciones de la proteína no contribuyen a la especificidad enzimática o
a la acción de las enzimas. Por eso, solo relativamente pocos residuos de
aminoácidos están implicados directamente en el proceso catalítico ¡quizás
menos de cinco! Se debe señalar también que el ajuste entre una parte de la
superficie de la enzima y el sustrato no se encuentra estático, sino que es una
interacción dinámica en la que el sustrato induce a cambios estructurales a la
molécula de la enzima, como la mano cambia de aspecto dentro de un guante.